Newsletter
Antikörper – Abwehrmechanismen der B-Zellen
Antikörper werden von Plasmazellen und Gedächtniszellen gebildet, Bild: Open Science - Lebenswissenschaften im Dialog, created with BioRender.com (CC BY-ND 3.0 AT)
Dieser Artikel bietet eine sehr umfangreiche und detaillierte Information zur Entstehung und Funktion der Antikörper beim Menschen. Es gibt auch eine einfachere Version dieses Artikels.
Als Antikörper – oder auch Immunglobuline (Ig) – werden spezielle Proteine unseres Immunsystems bezeichnet. Diese werden als Antwort auf so genannte Antigene von einer bestimmten Untergruppe der weißen Blutkörperchen, den B-Zellen (B-Lymphozyten), gebildet. Antikörper zirkulieren im Blut und in der Lymphe und sind auch in Körpersekreten zu finden. Sie dienen der Bekämpfung von Krankheitserregern und Fremdstoffen in unserem Körper, spielen aber auch bei Allergien und Autoimmunerkrankungen eine wichtige Rolle. Bei einer Impfung wird dieser Mechanismus unseres Körpers genutzt: Es wird eine Immunantwort hervorgerufen, und Antikörper werden produziert.
Entdeckung der Antikörper
Die Geschichte der Antikörper reicht weit zurück. Bereits Ende des 19. Jahrhunderts wusste man, dass das Blut von Tieren nach einer Infektion mit Bakterien ebendiese in Kultur zerstören konnte.
Als Geburtsstunde der Antikörper gilt jedoch eine 1890 veröffentlichte Arbeit von Emil von Behring und Shibasaburo Kitasato. Die beiden Wissenschaftler beschrieben darin, dass an Tetanus erkrankte Mäuse durch die Gabe von Serum von Kaninchen, die gegen Tetanus immun waren, geheilt werden konnten [1]. Tetanus (Wundstarrkrampf) ist eine bakterielle Infektionskrankheit, bei der die Toxine des Bakteriums Clostridium tetani Muskelkrämpfe verursachen. Unbehandelt kann diese Krankheit zum Tod führen. Auch für Diphterie – hervorgerufen durch das toxinbildende Bakterium Corynebacterium diphtheriae – konnte eine Serumtherapie bei Tieren bald erfolgreich angewandt werden.
In weiterer Folge gelang es von Behring gemeinsam mit Paul Ehrlich, mithilfe von Blutserum von Ziegen und Pferden auch an Diphtherie erkrankte Menschen zu heilen [2]. Offensichtlich gab es in den Blutseren der Tiere eine bestimmte antitoxische Aktivität, die man übertragen konnte. Diese wurde für die Versuche quantifiziert, und standardisierte „Immunitätseinheiten“ wurden für die Behandlungen eingesetzt. Der von Ehrlich geprägte Begriff „Antikörper“ setzte sich dann 1891 durch [3]. Von Behring wurde für seine Arbeit 1901 mit dem ersten Medizin-Nobelpreis der Geschichte ausgezeichnet. Ehrlich erhielt 1908 für seine Forschung an Antikörpern den Nobelpreis für Medizin.
Im weiteren Verlauf der Zeit verstand man immer besser, wie Antikörper entstehen und funktionieren. Serum von Menschen oder Tieren wurde zur Gewinnung von Antikörpern eingesetzt und zur Bekämpfung verschiedener Erreger genutzt. Diese Therapien basierten stets auf dem Vorhandensein sogenannter polyklonaler Antikörper. Darunter versteht man Antikörper-Gemische, die von verschiedenen B-Zellen stammen.
Monoklonale Antikörper
Oft hört man im Zusammenhang mit Antikörpern den Begriff „Monoklonale Antikörper“. Die Ära der monoklonalen Antikörper wurde in den 1970er-Jahren von Georges Köhler und César Milstein eingeleitet: Ihnen gelang es 1975 erstmals, B-Lymphozyten und Myelomzellen zu verschmelzen und mithilfe des daraus resultierenden Zellklons Antikörper mit einheitlicher Molekülstruktur und Spezifität herzustellen [4]. Köhler und Milstein erhielten 1984 den Medizin-Nobelpreis.
Monoklonale Antikörper sind polyklonalen Antikörpern, welche bei einer natürlich ablaufenden Immunreaktion des Körpers auf ein Antigen entstehen, in vielerlei Hinsicht überlegen:
- Polyklonale Antikörper sind die Produkte von B-Zellen mehrerer Zellklone, die verschiedene Strukturen des Zielantigens mit variabler Spezifität und Affinität erkennen. Nach der Immunisierung eines Individuums müssen polyklonale Antikörper vor der Verwendung aufgereinigt werden. Es können je nach Charge Schwankungen auftreten, und es kann zu Kreuzreaktionen kommen.
- Monoklonale Antikörper hingegen gehen aus ein und derselben B-Zelle hervor, die im Labor künstlich durch gezielte Proliferation zu einer Zelllinie geklont wurde. Monoklonale Antikörper haben alle dieselbe, konstante Struktur und binden ein Antigen an einer ganz bestimmten Stelle, das heißt sie richten sich gegen ein einziges Epitop. Obwohl die Herstellung monoklonaler Antikörper aufwändiger ist als jene polyklonaler Antikörper, sind sie diesen überlegen. Monoklonale Antikörper weisen geringere Kreuzreaktivitäten auf, können in großer Menge mit gleicher Qualität hergestellt werden und sind außerdem leichter aufzureinigen als polyklonale Antikörper.
Monoklonale Antikörper spielen heute eine wichtige Rolle in der biologischen Forschung und der Biotechnologie und finden als therapeutische Antikörper Anwendung in der Medizin.
Form, Struktur und Klassen von Antikörpern
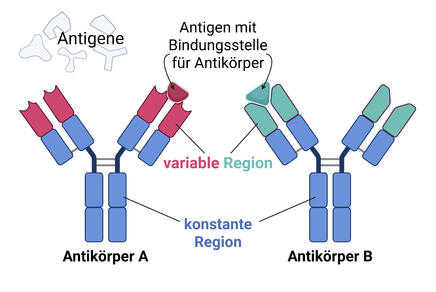
Bei Antikörpern (= Immunglobulinen, Ig) handelt es sich um Glykoproteine – also Makromoleküle aus einem Protein und Zuckergruppen – die aus insgesamt vier Bestandteilen aufgebaut sind: Aus zwei identischen schweren und zwei identischen leichten Ketten. Durch Disulfidbrücken zwischen den einzelnen Ketten erlangen Antikörper ihr Y-förmiges Aussehen (Abbildung 1) [5].
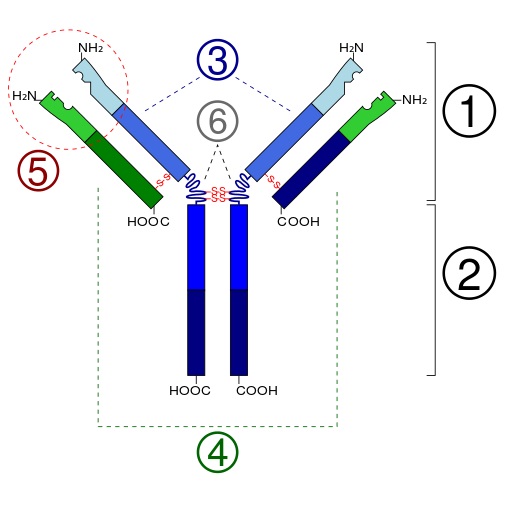
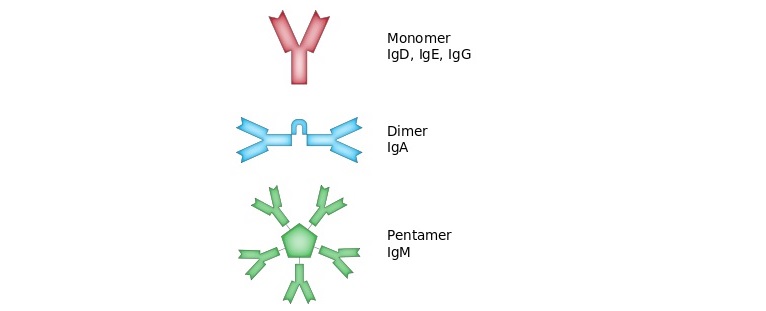
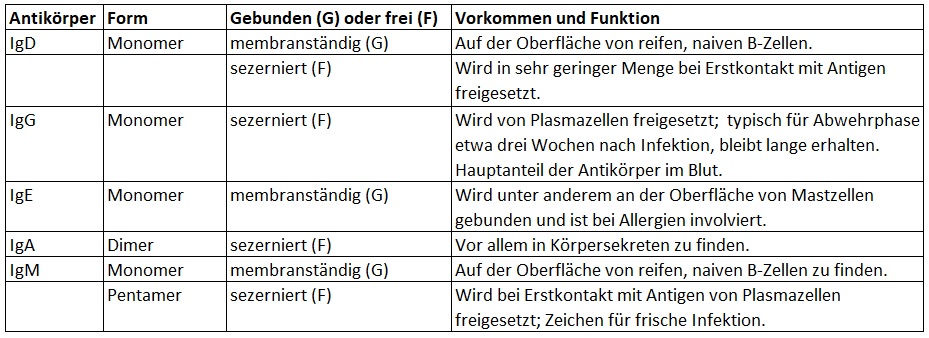
Antikörper können entweder membrangebunden an der Oberfläche von Zellen oder in sekretierter Form als so genannte sezernierte Antikörper vorkommen. Beim Menschen gibt es fünf verschiedene Antikörper-Klassen (Isotypen), welche in unterschiedlichen Formen vorliegen (siehe Abbildung 2): IgD, IgE und IgG als Monomer, also einzelnes Makromolekül; IgA als Dimer aus zwei gleichartigen Untereinheiten (Monomeren); sezerniertes IgM als Pentamer aus fünf gleichen Untereinheiten [5].
Die einzelnen Antikörper-Isotypen unterscheiden sich in ihrem Vorkommen und ihrer Funktion (Tabelle 1) [5, 6].
Funktion von Antikörpern
Die im Zuge einer Immunantwort produzierten Antikörper haben unterschiedliche Funktionen [6]:
-
Antikörper binden an Antigen. Im Fall von bakteriellen Toxinen oder der Oberfläche von Viren und Bakterien kann dies allein schon für die so genannte Neutralisation ausreichen: Das Pathogen und/oder seine Produkte werden durch das Binden der Antikörper neutralisiert, man spricht von neutralisierenden Antikörpern. Bei einer Virusinfektion können solche Antikörper beispielsweise das Binden des Virus an oder dessen Eintritt in die Zelle verhindern.
-
An Antikörper gebundenes Antigen wird von bestimmten Immunzellen erkannt. Verschiedene Zellen des Immunsystems können ein mit Antikörpern „markiertes“ Antigen über Rezeptoren an ihrer Oberfläche erkennen und binden. Dadurch werden Reaktionen in Gang gesetzt, die der Bekämpfung des Antigens dienen. So funktioniert beispielsweise das Eliminieren eines mit Antikörpern besetzten Erregers durch Fresszellen besser als ohne Antikörper-Signal.
-
Antikörper aktivieren das Komplementsystem. Dieses bestehtaus verschiedenen Proteinen und dient der direkten Zerstörung von Zellen und Erregern sowie der Aktivierung des Immunsystems. Antikörper können bestimmte Bestandteile des Komplementsystems binden und Kaskaden in diesem Systems aktivieren.
Antikörper bei Neugeborenen
Antikörper sind Teile des erworbenen (adaptiven) Immunsystems und werden von B-Zellen als Antwort auf Antigene gebildet. Als Antigene werden Moleküle oder Strukturen, die das menschliche Immunsystem als „fremd“ erkennt, bezeichnet. Das erworbene Immunsystem ist schon bei der Geburt vorhanden. Doch die B-Zellen (B-Lymphozyten) von Neugeborenen sind noch nicht voll einsatzfähig, und beim Kontakt mit einem Antigen reagieren sie mir einer schwächeren Immunantwort als bei Erwachsenen [7]. Außerdem binden Antikörper von Neugeborenen mit deutlich geringerer Affinität an Antigen als Antikörper von Erwachsenen.
Schon bei der Geburt haben Säuglinge einen gewissen Immunschutz. Bestimmte Antikörper der Mutter – vorwiegend Immunglobuline der Klasse G (IgG) – gelangen nämlich noch im Mutterleib über die Plazenta in das Blut des Fötus. Die Antikörper können dann über mehrere Wochen und Monate aktiv bleiben und das Kind schützen, nach spätestens sechs Monaten jedoch ist dieser Schutz vorbei [9]. Auch durch Stillen wird das Immunsystem des Neugeborenen unterstützt, denn über die Muttermilch bekommen Säuglinge weitere Antikörper – vorwiegend IgA – von der Mutter. Aus diesem Grund bekommen gestillte Säuglinge auch weniger häufig Infekte als jene, die mit Milchpräparaten gefüttert werden [8]. Es gibt auch Hinweise darauf, dass eine Mutter ihr Neugeborenes bis zu einem gewissen Maß vor COVID-19 schützen kann: Hat sie bereits eine Infektion mit SARS-CoV-2 durchgemacht, kann sie ihr Neugeborenes durch Stillen und die so weitergegebenen Antikörper vermutlich davor schützen beziehungsweise einen schweren Verlauf der Krankheit verhindern [10].
Nach der Geburt ist ein Neugeborenes mit einem Mal einer enormen Anzahl an Antigenen ausgesetzt. Durch den laufenden Antigenkontakt werden die Komponenten seines Immunsystems ständig gefordert und entwickeln sich in einem Lernprozess weiter. Man geht heute davon aus, dass das kindliche Immunsystem etwa ab dem fünften Lebensjahr jenem eines Erwachsenen gleicht [11].
Entwicklung von B-Zellen im Knochenmark und in der Peripherie
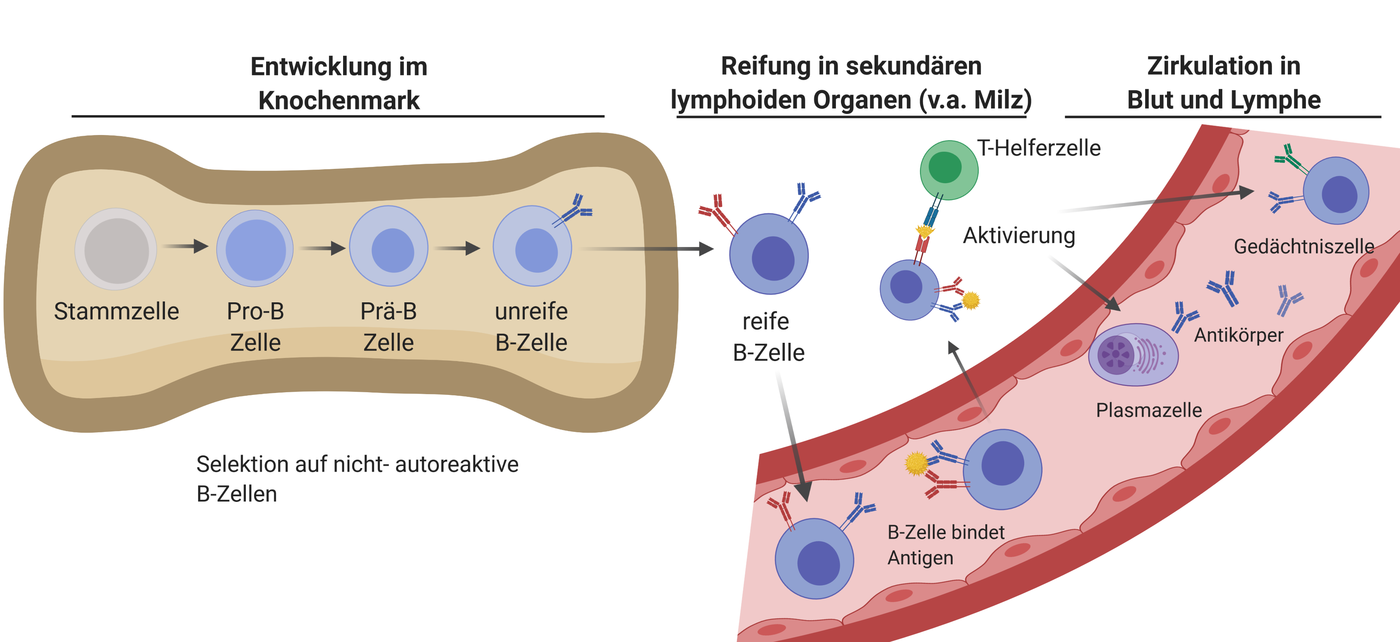
Während der Entwicklung im Mutterleib entstehen die B-Zellen des Fötus zunächst in der Leber und später auch im Knochenmark. Ab der Geburt findet die Entwicklung von B-Zellen ausschließlich im Knochenmark statt.
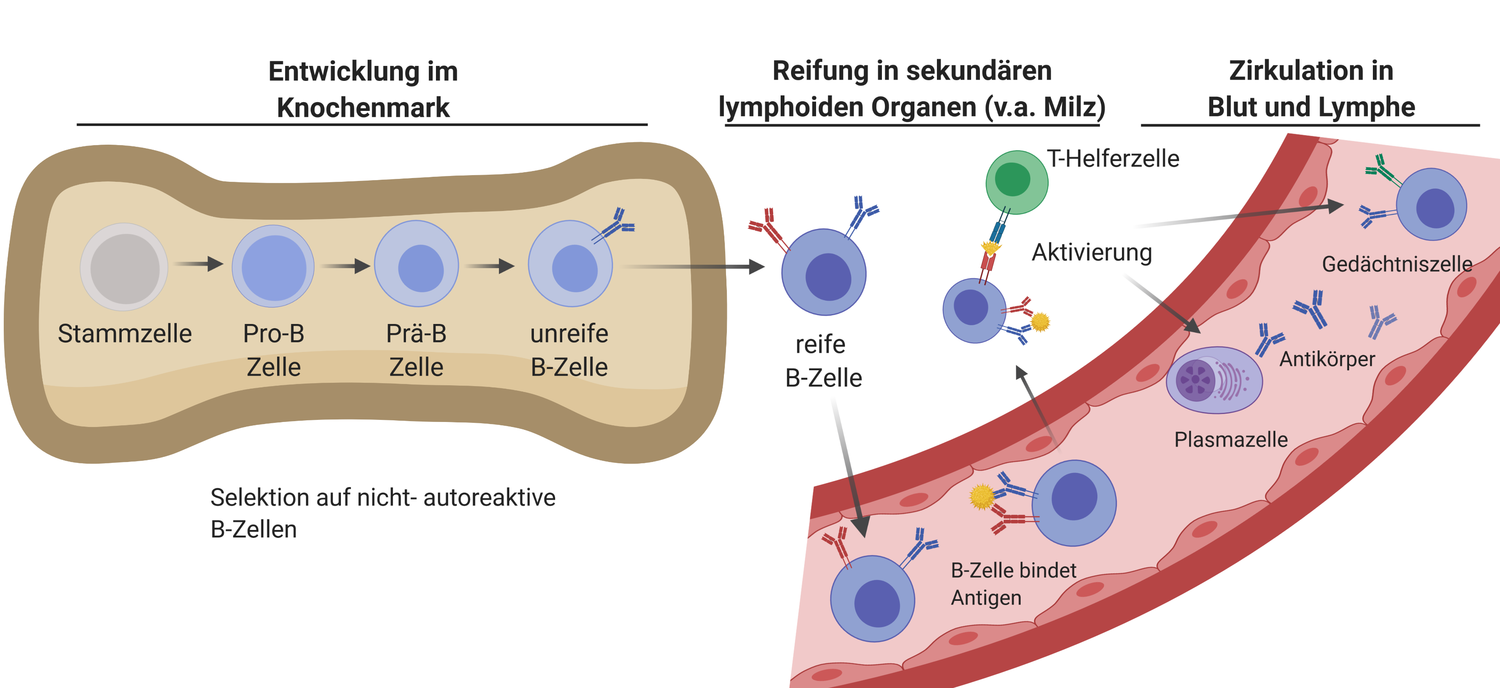
Im Knochenmarkentstehen kontinuierlich aus Blut-Stammzellen zunächst Vorläuferzellen von B-Zellen. Diese reifen schrittweise heran, bis sie so genannte B-Zell-Rezeptoren (BCR) an ihrer Oberfläche tragen [12, 13]. BCR sind membrangebundene Formen von zunächst IgM- und später auch IgD-Antikörpern, mit deren Hilfe B-Zellen Antigene erkennen und bekämpfen können. Antikörper entstehen also nicht erst als Reaktion auf Antigene, sie liegen während der B-Zell-Entwicklung schon als membrangebundene Formen an der Zelloberfläche vor. Eine B-Zelle besitzt mehrere tausende BCR an ihrer Zelloberfläche, diese sind jedoch alle spezifisch für ein einziges Antigen.
Im menschlichen Körper könnten theoretisch 1015 B-Lymphozyten heranreifen, die sich alle in ihren BCR unterscheiden und verschiedene Antigene bzw. Epitope binden könnten. Dieses riesige B-Zell-Repertoire eines Individuums kommt durch einen faszinierenden Trick des Immunsystems zustande: Aus der DNA, welche die Information für den Antigen-bindenden Teil des BCR enthält, werden Teile herausgeschnitten, und die DNA wird wieder neu zusammengefügt (Rekombination). Dadurch können aus einer einzigen DNA-Sequenz viele neue Sequenzen – und somit BCR-Spezifitäten – entstehen. Wie viel von dem möglichen BCR-Repertoire tatsächlich genutzt wird, ist noch nicht bekannt [14]. Tatsache ist jedoch, dass beinahe jedes Antigen, das in den Körper eindringt, von einer passenden B-Zelle erkannt und bekämpft werden kann.
Noch während ihrer Ausreifung im Knochenmark werden B-Zellen, deren BCR körpereigene Antigene binden, ausselektiert und unschädlich gemacht. Ein weiterer Selektionsprozess findet auch noch außerhalb des Knochenmarks statt. Fehler beim Ausselektieren autoreaktiver B-Zellen können zum Entstehen von Autoimmunerkrankungen beitragen, bei denen Autoantikörper – das sind Antikörper, die sich gegen ein körpereigenes Antigen richten – involviert sind. Nur B-Zellen mit nicht autoreaktiven BCR verlassen als unreife (immature) B-Zellen das Knochenmark und wandern zu den sekundären lymphoiden Organen, hauptsächlich der Milz und den Lymphknoten [12, 13].
In den sekundären lymphoiden Organen – vor allem in der Milz – entwickeln sich die unreifen zu reifen B-Zellen weiter. Diese verlassen diese Organe und zirkulieren zwischen Blut, Lymphe und den lymphatischen Organen des Körpers (Thymus, Milz, Lymphknoten, Knochenmark). Die Aufgabe der reifen B-Zellen ist es, fremde Antigene im Körper aufzuspüren und für das Immunsystem zu kennzeichnen. Man spricht von naïven B-Zellen, wenn diese noch keinen Kontakt mit Antigen hatten.
B-Zell-Aktivierung: Plasmazellen und Gedächtniszellen
Eine antigenunerfahrene (naïve) B-Zelle trifft bei ihrem Screeningvorgang im Körper entweder genau auf das Antigen, das sie über ihren BCR erkennt, und wird aktiviert, oder sie stirbt innerhalb weniger Tage. Aus diesem Grund werden B-Zellen auch kontinuierlich gebildet. Im Fall der Antigenerkennung gibt es zwei Möglichkeiten der Aktivierung:
- T-Zell-abhängige Aktivierung: Die naïve B-Zelle erkennt über den BCR an ihrer Oberfläche ein Antigen und bindet dieses an einer bestimmten Stelle, dem so genannten Epitop. In diesem Fall wird die B-Zelle vor dem Tod gerettet. Sie zerlegt das Antigen in ihrem Inneren und präsentiert einen Teil davon über den Major Histocompatibility Complex-II (MHC-II) an ihrer Oberfläche. So durchwandert sie dann Lymphknoten und Milz. Begegnet sie auf ihrem Weg anderen spezialisierten weißen Blutzellen, den T-Helferzellen, die das von ihr präsentierte Stück vom Antigen über deren T-Zell-Rezeptor (TCR) erkennen, wird die B-Zelle aktiviert (Abbildung 4).
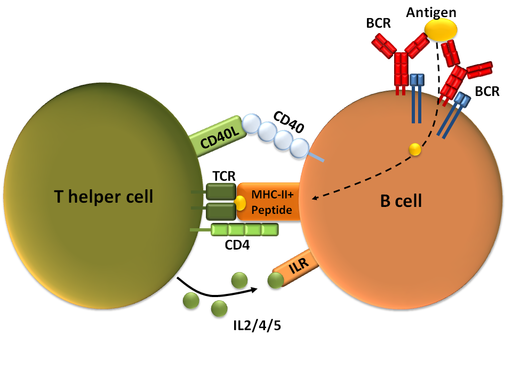
Die so aktivierte B-Zelle durchläuft anschließend eine große Anzahl an Teilungen (Proliferation) – ein Prozess, der als klonale Expansion bezeichnet wird. Es entsteht eine ganze „Zellarmee“ aus B-Zell-Klonen mit demselben BCR. In einem weiteren Reifungsprozess entwickeln sich so genannte Plasmazellen (= Effektor-B-Zellen), welche Antikörper der Klassen IgM, IgG, IgA oder IgE ausschütten können [15]. Die Antikörper – egal welcher Klasse – sind spezifisch für das ursprüngliche Antigen. Da während des Reifungsprozesses jedoch gezielt Mutationen eingeführt und auf bestimmte davon selektiert wurde, bilden die Antikörper von Plasmazellen das Antigen besser als der ursprüngliche BCR der naiven B-Zelle. Die Plasmazellen wandern zum Großteil ins Knochenmark, wo sie weiterhin Antikörper produzieren. Ihre Lebensdauer kann von mehreren Tagen bis zu mehreren Jahren variieren.
Ein Teil der Plasmazellen entwickelt sich zu so genannten Gedächtniszellen (Memory-B-Zellen) weiter [15]. Diese spezialisierten Zellen sind für das immunologische Gedächtnis unseres Körpers zuständig: Bei einer zweiten Immunantwort auf dasselbe Antigen können diese Gedächtniszellen schneller als naive B-Zellen aktiviert werden und Antikörper produzieren. Außerdem bindet ihr BCR aufgrund der gezielten Mutationen bereits besser an das Antigen. Somit ist die zweite Reaktion des Immunsystems auf ein Antigen immer schneller und stärker als die erste. Das Prinzip der Impfung (Verlinken auf Wissens-Artikel zum Impfen) basiert auf der Bildung von Gedächtniszellen.
- T-Zell-unabhängige Aktivierung: Es gibt auch die – eher seltene – Möglichkeit der T-Zell-unabhängigen Aktivierung von naïven B-Zellen. Einige Antigene, wie beispielsweise sich wiederholende Polysaccharide an der Oberfläche von Bakterien, können B-Zellen ohne die Hilfe von T-Zellen aktivieren. In diesem Fall werden ausschließlich Antikörper der Klasse IgM gebildet, welche eine geringe Antigen-Affinität haben, und es entstehen keine Gedächtniszellen [16]. Daher beträgt der Schutz bei einer Impfung mit Polysaccharid-Impfstoffen nur rund drei bis sechs Jahre (Link zum Impf-Artikel).
Das Immunsystem ist – neben dem Gehirn – eines der komplexesten Systeme des menschlichen Körpers. Obwohl an seine Entwicklung und Funktion schon lange geforscht wird, gibt es noch viele offene Fragen. Das Immunsystem ist und bleibt somit ein Hot Topic von Forschung und Entwicklung. Die weltweite Corona-Pandemie hat deutlich gezeigt, wie wichtig ein grundlegendes Verständnis des Immunsystems zur Bekämpfung von Krankheiten ist.
as, 10.12.2021
Quellenangaben
[1] Behring E, Kitasato S (1890). Über das Zustandekommen der Diphtherie-Immunität und der Tetanus-Immunität bei Thieren. Deutsche Medicinische Wochenschrift, 16:1113–1114.
[2] Ehrlich P, Kossel H, Wassermann A (1894). Ueber Gewinnung und Verwendung des Diphterieheilserums. Deutsche Medicinische Wochenschrift, 20:353–355.
[3] Ehrlich P (1891). Experimentelle Untersuchungen über Immunität. II. Ueber Abrin. Dtsch. med. Wochenschrift, 17:1218.
[4] Leavy O.: The birth of monoclonal antibodies (2016). Nature Immunology volume 17, pageS13(2016)
[5] Janeway CA, Travers P., Walport M. and Shlomchik MJ: Immunobiology, 5th edition. The Immune System in Health and Disease (2001). Chapter 9-12 ff (https://www.ncbi.nlm.nih.gov/books/NBK27162/#A1227)
[6] Forthal DN: Functions of antibodies (2014). Microbiol Spectr. 2014 Aug 15; 2(4): 1–17.
[7] Simon AK, Hollander GA and McMichael A.: Evolution of the immune system in humans from infancy to old age (2015). Proc R Soc B 282 (2015) 1–9.
[8] Hanson LA: Breastfeeding provides passive and likely long-lasting active immunity (1998). Ann Allergy Asthma Immunol. 1998 Dec;81(6):523-33; quiz 533-4, 537. doi: 10.1016/S1081-1206(10)62704-4.
[9] Basha S., Surendran N. and Pichicero M.: Immune Response in Neonates (2014). Expert Rev Clin Immunol 10 (2014) 1171-1184.
[10] Wolf Lebrão C., Navarro Cruz M., da Silva MH et al.: Early Identification of IgA Anti-SARSCoV-2 in Milk of Mother With COVID-19 Infection (2020). J Hum Lact. 2020 Nov;36(4):609-613. doi: 10.1177/0890334420960433.
[11] Bufe A. and Peters M.: Konsequenzen für die Praxis: Unterschiede zwischen kindlichem und erwachsenem Immunsystem (2013). Haut 02, 2013
[12]: Melchers F.: Checkpoints that control B cell development (2015). JCI May 4, 2015, doi: 10.1172/JCI78083
[13] Busslinger M.: Transcriptional control of early B cell development (2004). Annu Rev Immunol. 2004; 22:55-79. doi: 10.1146/annurev.immunol.22.012703.104807.
[14] Rees AR: Understanding the human antibody repertoire (2020). MAbs. 2020 Jan-Dec; 12(1): 1729683.
[15] Wong R. and Bhattacharya B.: Basics of memory B‐cell responses: lessons from and for the real world (2019). Immunology. 2019 Feb; 156(2): 120–129.
[16] Allman D., Wilmore JR and Gaudette BT: The Continuing Story of T-cell Independent Antibodies (2020). Immunol Rev. 2019 Mar; 288(1): 128–135. doi: 10.1111/imr.12754
Ansprechpartner:
- Alexandra Schebesta