Newsletter
Die menschliche Haut
Die Haut erfüllt einige lebensnotwendige Aufgaben., Bild: Fermi auf Pixabay (CC0)
Unsere Haut ist ein zentrales Organ mit zahlreichen lebenswichtigen Funktionen. Sie ist mehr als nur eine äußere Hülle – unter anderem schützt uns die Haut vor Krankheitserregern und ermöglicht Kommunikation mit der Umwelt. Dieser Beitrag fasst den Aufbau und die Funktionen der Haut zusammen und stellt die neuesten Forschungsansätze zur Wundheilung und Narbenbildung vor.
Die menschliche Haut ist weit mehr als nur eine schützende Hülle, die unseren Körper umgibt, nämlich ein hochkomplexes Organ mit zahlreichen Funktionen. Entgegen einer weitverbreiteten Annahme stellt sie mit einer funktionellen Oberfläche von etwa 1,5 bis 2 m² und einem Anteil von rund 5,5 % am Körpergewicht nicht das größte Organ des menschlichen Körpers dar. Zum Vergleich: Die größte Oberfläche besitzt der menschliche Darm mit rund 300 bis 400 m², und die Skelettmuskulatur macht in etwa 36 bis 42 % des menschlichen Körpergewichts aus.
Die Haut ist ein unersetzliches Organ, das uns vor Umwelteinflüssen schützt, Sinneseindrücke vermittelt und aktiv zur Immunabwehr beiträgt. Täglich ist sie einer Vielzahl mechanischer, thermischer, chemischer und mikrobieller Reize ausgesetzt und reagiert darauf mit komplexen Schutz- und Reparaturmechanismen [1].
Allgemeine Aufgaben der Haut
Die Haut erfüllt zahlreiche lebenswichtige Aufgaben und schützt den Körper unter anderem vor schädlichen Umwelteinflüssen. Dazu zählen sowohl der Schutz vor Kälte und Hitze als auch der vor ultravioletter Strahlung. Die Haut besteht aus dichten Zellverbindungen und verhindert mit ihrer natürlichen Schutzschicht aus Lipiden, der so genannte Lipidbarriere, den übermäßigen Verlust von Wärme und Wasser. So sichert sie den Flüssigkeits- und Elektrolythaushalt des Körpers. Darüber hinaus bewahrt sie uns vor dem Eindringen chemischer Substanzen und bietet einen ersten Schutz gegen Krankheitserreger wie Bakterien, Viren und Pilze.
Neben dieser passiven Schutzfunktion übernimmt die Haut auch eine Vielzahl aktiver Aufgaben. Sie ist ein hochspezialisiertes Sinnesorgan, das Reize wie Druck, Temperatur, Berührung, Vibration und Schmerz wahrnimmt und über Nervenbahnen an das zentrale Nervensystem weiterleitet. Zudem ist sie ein wichtiger Bestandteil der Immunabwehr. Immunzellen in den äußersten Hautschichten erkennen potenzielle Krankheitserreger und lösen gezielte Immunreaktionen aus. Darüber hinaus ist die Haut auch in der Lage, bestimmte Wirkstoffe aufzunehmen – eine Eigenschaft, die man sich etwa bei der Applikation von Medikamenten über die Haut zunutze macht. Durch die Produktion und Abgabe von Schweiß über spezielle Drüsen spielt die Haut auch eine wichtige Rolle bei der Regulation der Körpertemperatur und der Ausscheidung von Stoffwechselprodukten [2].
Entwicklung, Aufbau und Funktion der Haut
Die menschliche Haut besteht aus drei Hauptschichten: der Epidermis (Oberhaut), der Dermis (Lederhaut) und der Subkutis (Unterhaut). Jede dieser Schichten erfüllt spezifische Aufgaben und steht in engem funktionellem Austausch mit den anderen.
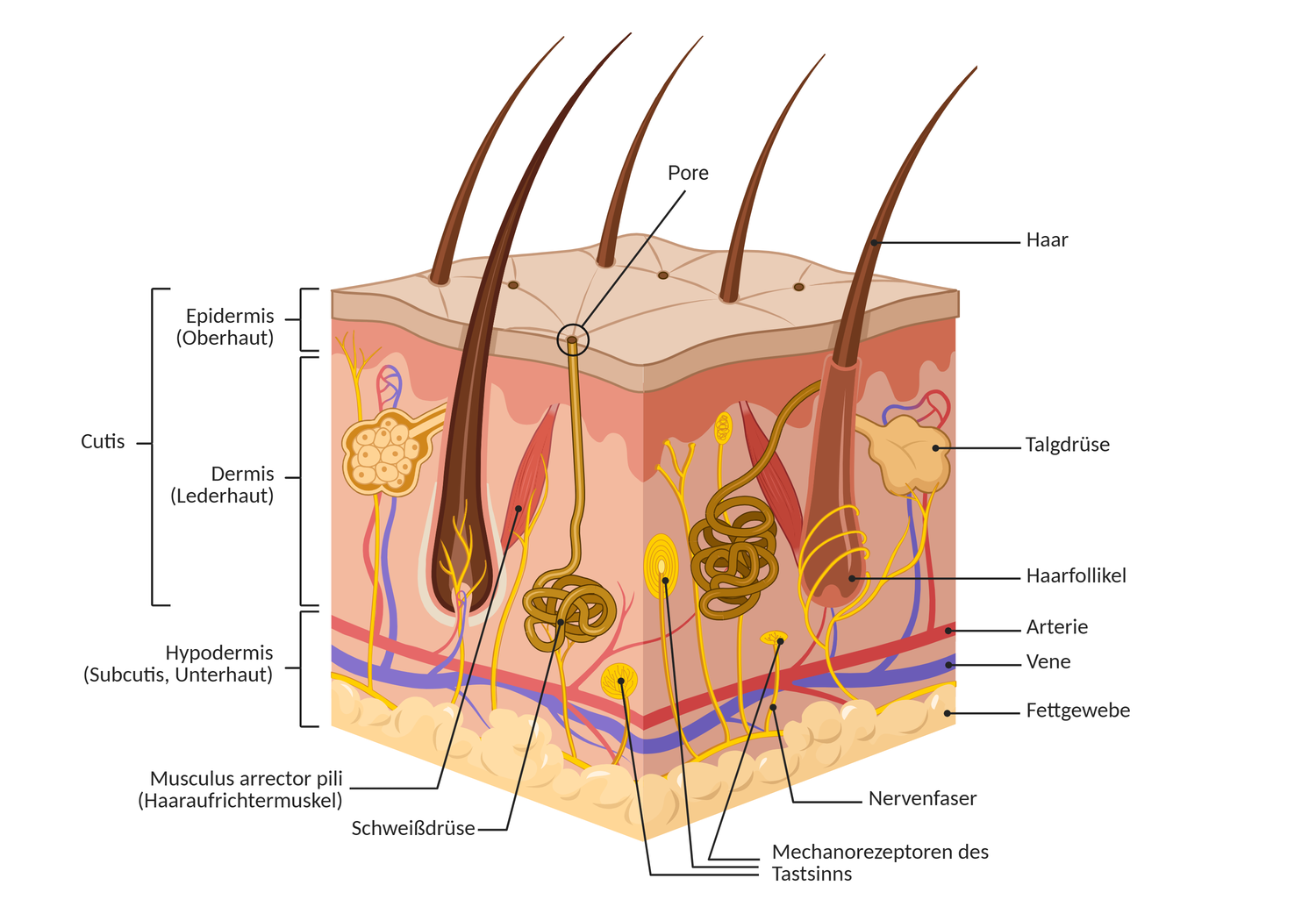
Epidermis (Oberhaut)
Als oberste Schicht der Haut bildet die Epidermis (Oberhaut) die erste Barriere gegenüber der Außenwelt. Sie durchläuft in der Embryonalentwicklung mehrere Reifungsstadien und besteht in der dritten Schwangerschaftswoche zunächst aus einer einzigen Schicht undifferenzierter Zellen. Ab der fünften Schwangerschaftswoche entwickelt sich ein zweischichtiger Aufbau: Die unterste Basalzellschicht sorgt ein Leben lang für neue Hautzellen, und darüber liegt das so genannte transiente Periderm – eine vorübergehende Hautschicht, die die noch unreife Haut des Embryos schützt. Zwischen der achten Woche und dem zweiten Trimester beginnt die Schichtung (Stratifizierung), und ab etwa der 24. Woche setzt auch die Keratinisierung, also die Verhornung, ein. Zu diesem Zeitpunkt ähnelt die Epidermis bereits der Struktur der adulten Haut [3].
Die Dicke der Epidermis variiert je nach Körperregion: Sie ist an den Augenlidern am dünnsten und an der sogenannten Leistenhaut (Handflächen und Fußsohlen) am dicksten.
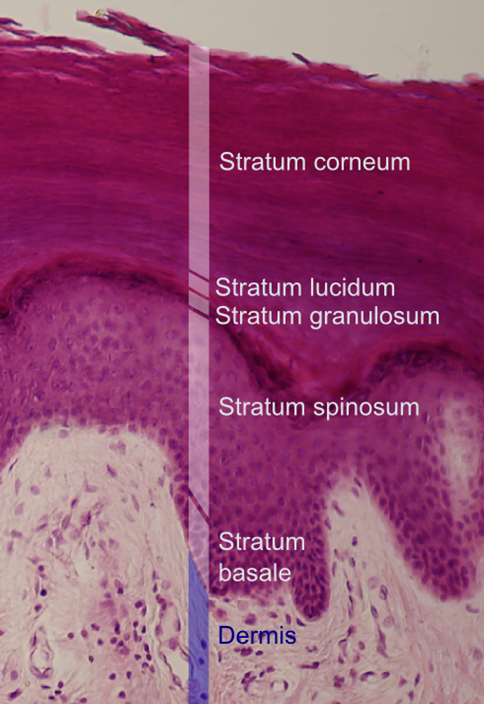
Die Epidermis besteht zu einem Hauptteil aus speziellen Zellen, den Keratinozyten, die in mehreren Schichten organisiert sind:
- Stratum basale: Die unterste Schicht besteht aus teilungsfähigen Basalzellen, die für die ständige Erneuerung der Epidermis sorgen.
- Stratum spinosum: Mehrere Lagen stachelartig verbundener Zellen verleihen der Haut mechanische Festigkeit.
- Stratum granulosum: Die Zellen dieser Schicht geben lipidhaltige Substanzen ab, welche eine effektive epidermale Barriere gegen Wasserverlust und Schadstoffe bilden.
- Stratum lucidum (nur in Leistenhaut): Eine Übergangsschicht aus abgestorbenen, aber noch nicht vollständig verhornten Zellen.
- Stratum corneum: Die äußerste Schicht besteht aus kernlosen Korneozyten, also Hornzellen, die in eine lipidreiche Matrix eingebettet sind. Diese Hornschicht bildet einen zentralen Bestandteil des mechanischen und chemischen Schutzes.
Zusätzliche Zelltypen der Epidermis übernehmen spezialisierte Funktionen. So etwa produzieren Melanozyten Melanin zum Schutz vor UV-Strahlung, Langerhans-Zellen übernehmen immunologische Funktionen, und Merkel-Zellen sind an der Wahrnehmung von Druckreizen beteiligt. Zusammenfassend schützt die Epidermis nicht nur vor Umwelteinflüssen, sondern ist aktiv an der Immunabwehr, der Sensorik und der Hautregeneration beteiligt [2].
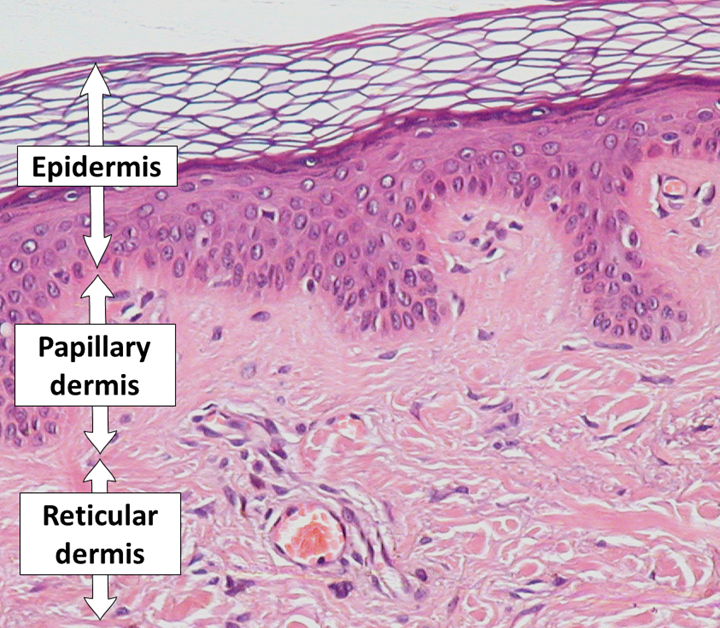
Dermis (Lederhaut)
Die Dermis (Lederhaut) liegt direkt unter der Epidermis und verleiht der Haut ihre mechanische Stabilität und Elastizität. Sie besteht aus einem dichten Bindegewebe, das in zwei anatomisch und funktionell unterscheidbare Schichten gegliedert ist: die papilläre Dermis (Stratum papillare) und die retikuläre Dermis (Stratum reticulare).
Im Embryo ist das zukünftige Dermisgewebe während des ersten Trimesters einer Schwangerschaft noch wässrig und zellreich. Ab der 12. Schwangerschaftswoche bilden sich zunehmend Kollagenfasern, und um die 15. Woche entwickeln sich die papilläre und retikuläre Dermis. Bei Geburt ähnelt die Dermis bereits weitgehend der eines Erwachsenen.
- Die papilläre Dermis besteht aus lockerem Bindegewebe mit feinen, unregelmäßigen Kollagenfaserbündeln und zahlreichen feinsten Blutgefäßen. Kleine, zapfenförmige Ausstülpungen, so genannte Papillen, ragen in die Epidermis hinein, verzahnen sich mit dieser und ernähren sie. Gleichzeitig beherbergt diese Hautschicht viele sensorische Nervenendigungen, welche die Grundlage für die feine Tastempfindung der Haut bilden.
- Die retikuläre Dermis ist dichter strukturiert und enthält dicke, netzartig organisierte Kollagen- und elastische Fasern. Diese Schicht sorgt für die mechanische Belastbarkeit der Haut. Hier verlaufen auch größere Blutgefäße, Nerven, Schweißdrüsen, Talgdrüsen, und Haarfollikel. Mit den Haarfollikeln ist ein spezieller Muskel, der Musculus arrector pili, verbunden, der bei Kältereizen oder emotionalem Stress die Haare aufrichten kann („Gänsehaut“).
Die extrazelluläre Matrix ist ein Netzwerk, das zwischen den Zellen im Gewebe liegt und aus verschiedenen Makromolekülen wie beispielsweise Kollagen besteht. Sie ist für die Struktur, Elastizität und das gesunde Funktionieren der Haut verantwortlich. In der Dermis ist die extrazelluläre Matrix ausgeprägter als in der Epidermis und speichert und verteilt in dieser Hautschicht Wasser, Wachstumsfaktoren und Signalmoleküle und schafft damit ein dynamisches Mikromilieu, das Zellfunktionen reguliert. In der Epidermis trägt sie zur Verankerung der Zellen und zur Bildung der Hautbarriere bei. Dabei hinaus fördert die extrazelluläre Matrix die Zellanhaftung, -migration und -kommunikation, allesamt essenzielle Prozesse bei Gewebeerneuerung und Wundheilung [4].
Zudem befinden sich im Gewebe zwischen den Zellen und der extrazellulären Matrix der Dermis zahlreiche Immunzellen, darunter dendritische Zellen, Makrophagen, Mastzellen, T-Zellen sowie gelegentlich neutrophile oder eosinophile Granulozyten. Die dendritischen Zellen in der Dermis und spezielle dendritische Zellen der Epidermis, so genannte Langerhans-Zellen, zählen zu den professionellen antigenpräsentierenden Zellen. Sie nehmen fremde Antigene – also fremde Stoffe, die eine Reaktion des Immunsystems auslösen – auf und wandern über die Lymphgefäße zu regionalen Lymphknoten. Dort präsentieren sie die Antigene spezialisierten Immunzellen, um eine adaptive Immunantwort auszulösen. Diese Mechanismen sind zentral für den Schutz vor eindringenden Krankheitserregern, etwa bei bakteriellen Hautinfektionen oder Virusbefall (z. B. Herpes simplex).
Makrophagen sind sowohl am „Fressen“ (der Phagozytose) von Pathogenen und Zelltrümmern beteiligt als auch an der Regulation der Wundheilung. Sie beeinflussen durch die Produktion und Ausschüttung spezifischer Substanzen das lokale Entzündungsgeschehen und die Geweberegeneration. Dieser Prozess kann beispielsweise bei chronischen Wunden oder fibrotischer Narbenbildung gestört sein.
Mastzellen spielen eine Schlüsselrolle bei einer bestimmten Klasse von Allergien, wie sie etwa bei Kontakt mit Pollen, Hausstaubmilben oder Insektenstichen auftreten. Nach ihrer Aktivierung setzen sie Botenstoffe wie etwa Histamin frei. Dies führt zur Erweiterung der Blutgefäße, erhöhter Gefäßdurchlässigkeit, Juckreiz und Einwanderung von weißen Blutkörperchen – typischen Symptomen einer allergischen Hautreaktion wie der Urtikaria (Nesselsucht) oder dem atopischen Ekzem [5].
Subkutis (Unterhaut)
Die Subkutis (Unterhaut) besteht aus lockerem Binde- und Fettgewebe, das in Läppchen organisiert ist und durch Abgrenzungen aus Bindegewebe, so genannte Septen, unterteilt wird. Diese enthalten Blutgefäße und Nerven, die die darüberliegende Dermis versorgen. Im Embryo lagert sich bereits zwischen der 12. und 28. Schwangerschaftswoche zunehmend Fett an die Dermis an, wodurch sich die Hautstruktur der eines Neugeborenen annähert. Die Subkutis dient als Energiespeicher, Wärmeisolator und mechanisches Schutzpolster gegenüber äußeren Krafteinwirkungen [3].
Blut- und Lymphgefäßsystem der Haut
Die Haut verfügt über ein ausgeklügeltes Gefäßsystem, das eine zentrale Rolle in der Versorgung, Thermoregulation und Immunregulation spielt. Das Blutgefäßnetz gliedert sich in ein oberflächliches und ein tieferes horizontales Netzwerk. Vertikal verlaufende Gefäße verbinden diese Ebenen und versorgen unter anderem Haarfollikel, Talg- und Schweißdrüsen. Die Durchblutung kann je nach Bedarf (etwa bei Hitze oder Fieber) auf das bis zu 20-Fache gesteigert werden.
In der Haut finden bevorzugt an Orten mit niedriger Flussgeschwindigkeit des Blutes entzündliche Reaktionen statt. Nach ihrer Passage durch die Gefäßwand gelangen Immunzellen in das Zwischengewebe der Dermis, wo sie über das eng verzweigte Lymphgefäßsystem weitergeleitet werden. Dieses beginnt mit blind endenden Lymphkapillaren, welche die Gewebsflüssigkeit, Zellen, Zelltrümmer sowie potenzielle Pathogene aufnehmen und aktiv weitertransportieren. Das Lymphsystem ist essenziell für die Immunabwehr sowie für den Abtransport von Botenstoffen von Entzündungen und überschüssiger Flüssigkeit. Es stellt zudem den Hauptpfad für die Metastasierung maligner Hauttumore über die Lymphe dar. Die Haut fungiert somit nicht nur als physikalische, sondern auch als immunologische Barriere, die in ständiger Kommunikation mit dem Blut- und Lymphsystem steht [2].
Nervensystem und Sinnesfunktion der Haut
Die Haut ist ein hochsensibles Sinnesorgan, das von einem dichten Netzwerk von Nerven durchzogen ist. Dabei leiten die sensorischen Nerven die Information zu einer Vielzahl von Reizen, unter anderem Berührung, Druck, Schmerz, Temperatur und Juckreiz, von der Haut zum Gehirn und Rückenmark. Die Enden dieser Nerven liegen entweder frei in der Dermis oder sind Teil spezialisierter Rezeptoren wie Meissner-Tastkörperchen (für feine Berührungen) oder Pacini-Körperchen (für Vibrationen). Autonome Nerven in der Haut hingegen sorgen dafür, dass diese automatisch auf Umweltveränderungen wie etwa Temperatur oder Stress reagiert. Über das Nervensystem in der Haut werden des Weiteren auch neuroaktiver Peptide freigesetzt – so nennt man kleine Eiweißmoleküle, die von Nervenzellen produziert werden und als Botenstoffe wirken. Dies kann beispielsweise bei Reizung, Trockenheit, Stress, Schmerz oder Juckreiz bei Hauterkrankungen wie Neurodermitis erfolgen und führt zu einer erhöhten Durchlässigkeit der Gefäße, Schwellung und Aktivierung von Immunzellen [6].
Eine entscheidende Rolle bei der Funktion und Regeneration der Nervenfasern in der Haut spielen so genannte Schwann-Zellen. Diese speziellen Zellen umhüllen Nervenzellen und sorgen für deren elektrische Isolation. Schwann-Zellen sind auch aktiv an der Reparatur und Regeneration der Haut nach Verletzungen beteiligt: Unter bestimmten Bedingungen können sie Wachstumsfaktoren und Immunmediatoren freisetzen, die nicht nur die Nervenregeneration, sondern auch die Wundheilung und das Verhalten anderer Hautzellen beeinflussen.
Besonders wichtig: Die Haut vor der Sonne schützen
UV-Licht ist einer der größten Risikofaktoren die zur Entstehung von Hautkrebs führt. Dieses kurzwellige Licht ist in der Lage etliche Mutationen ins Genom unserer Zellen – je nach Zelltyp, UV-Belastung und DNA-Reparaturen in der Zellen – können tausende bis zehntausende Mutationen pro Zelle pro Tag, auftreten [7, 8]. Mutationen können im schlimmsten Fall zu Hautkrebs führen, wenn die Zelle es nicht schafft die DNA-Schäden zu reparieren: in Österreich erkrankten 2023 ca. 2000 Personen an Hautkrebs und rund 400 Personen starben an den Folgen der Erkrankung [9]. Um das Risiko zu minieren wird geraten sich unter anderem mit Sonnencreme zu schützen, besonders im Sommer wenn die UV-Belastung sehr hoch ist.
Was bedeutet der Lichtschutzfaktor?
Sonnenschutz ist entscheidend, um Hautschäden durch UV-Strahlung zu vermeiden. Eine wichtige Kennzahl dafür ist der Lichtschutzfaktor (LSF), der die Schutzwirkung eines Sonnenschutzmittels gegen UVB-Strahlen angibt. Der LSF gibt an, um wie viel länger man sich mit Sonnenschutzmittel in der Sonne aufhalten kann, ohne einen Sonnenbrand zu bekommen, verglichen mit ungeschützter Haut. Beispiel: Bei einem Eigenschutz der Haut von 10 Minuten und einem SPF 30 kann man sich theoretisch 30-mal länger, also 300 Minuten, schützen – vorausgesetzt, das Sonnenschutzmittel wird ausreichend und regelmäßig aufgetragen. Aber auch Sonnencremen mit sehr hohem Lichtschutzfaktor schützen nicht vollständig, deshalb wird empfohlen die theoretische Schutzdauer höchstens 60% auszureizen – also bei einem theoretischen 300 Minuten langen Schutz sollte man sich spätestens nach 180 Minuten wieder eincremen [10-12].
Wundheilung und Forschungsschwerpunkte
Die Haut besitzt eine beachtliche Regenerationsfähigkeit. Während kleinere oberflächliche Verletzungen rasch durch Zellteilung der Basalzellen der Epidermis verheilen, bedarf die Heilung tieferer Wunden komplexer Prozesse unter Einbeziehung diverser Zelltypen (darunter Fibroblasten, Keratinozyten, Endothelzellen, Immunzellen etc.). Auf eine akute Entzündungsreaktion folgen Zellteilung, Neubildung von Gefäßen und Matrix sowie schließlich eine Umbauphase, in der das Gewebe strukturell stabilisiert wird. Diese Abfolge sichert im besten Fall eine narbenfreie Regeneration der verletzten Stelle.
In einigen Fällen jedoch kommt es zu überschießender Narbenbildung. Bei hypertrophen Narben etwa entsteht zu viel Narbengewebe – aber nur dort, wo die Wunde war. Bei Keloiden hingegen entsteht eine Narbe, die sich über die Wunde hinaus ausbreitet. Diese pathologischen Narben stellen nach wie vor eine medizinische Herausforderung dar – nicht zuletzt wegen der eingeschränkten Therapieoptionen.
Ein zentraler Forschungsschwerpunkt der Arbeitsgruppe von Prof. Michael Mildner an der Medizinischen Universität (MedUni) Wien ist es, zu einem besseren Verständnis der zellulären und molekularen Mechanismen der Wundheilung und Narbenbildung beizutragen. Besonderes Augenmerk legen der Dermatologe und sein Team dabei auf die Rolle der Schwann-Zellen. Diese Zellen umhüllen Nervenfasern und sichern deren Funktion in der gesunden Haut. Nach Verletzungen verlieren sie zwischenzeitig den Kontakt zu den langen Fortsätzen der Nervenzellen und nehmen „Reparatur“-Eigenschaften an. Anschließend können sie in das Wundgebiet einwandern, dort aktiv die Geweberegeneration fördern sowie Immunzellen beeinflussen und somit zur Wiederherstellung des natürlichen Gleichgewichts der Haut beitragen.
Bleibt nach erfolgreicher Regeneration jedoch ein Reiz aus, der den Reparatur-Modus der Schwann-Zellen beendet, kann deren Aktivität andauern und krankhaft werden. Michael Mildner und sein Team konnten zeigen, dass in bestimmten überschießenden Narben, den Keloiden, Schwann-Zellen in großer Zahl vorhanden sind und zu einer lang andauernden, krankhaften Bindegewebsvermehrung beitragen. Interessanterweise zeigen sich bei anderen Erkrankungen, die durch Trauma, chronische Entzündung und gestörte Zell-Zell-Kommunikation ausgelöst werden und mit Schwann-Zellen assoziiert sind, ähnliche Merkmale [13].
Um die im Rahmen der pathologischen Wundheilung auftretenden Mechanismen näher erforschen zu können, entwickelte Mildner mit seinem Team in vitro 3D-Haut- und Narbenmodelle, die humane Krankheitsbilder möglichst genau nachbilden. In diesen 3D-Modellen in der Petrischale untersuchen die Forscher:innen das Zusammenspiel von Schwann-Zellen mit anderen Zelltypen.
Im Rahmen des Projekts Flower Power wird seit 2024 auch die Wirkung von pflanzlichen Extrakten auf Wundheilung und Narbenbildung erforscht. In Zusammenarbeit mit Schüler:innen und Pflanzenexpert:innen sollen traditionelle Heilpflanzen identifiziert und daraus Extrakte hergestellt werden, um deren Effekte in den 3D-Modellen zu testen. Ziel ist es, pflanzliche Wirkstoffe zu finden, die gezielt in den Heilungsprozess eingreifen und pathologische Narbenbildung hemmen können.
Darüber hinaus ist es das Ziel der Arbeitsgruppe Mildner, neue molekulare Strukturen zu identifizieren, die potenzielle therapeutische Zielmoleküle darstellen könnten. Dazu wird mittels High-Throughput-Screenings eine große Bandbreite an Wirkstoffen auf ihre Wirkung auf Schwann-Zellen getestet.
Ergänzend dazu wird der Einfluss von Herz-Kreislauf-Medikamenten auf die Hautregeneration untersucht. Erste Studien deuten darauf hin, dass solche Medikamente therapeutisch nutzbar sein könnten.
Neu gewonnene Erkenntnisse aus der Forschung von Mildner und seinen Mitarbeiter:innen tragen so zur Entwicklung innovativer Therapieansätze zur Förderung der Wundheilung und zur gezielten Prävention pathologischer Narbenbildung bei.
Wir möchten uns recht herzlich bei Michael Mildner und Hannes Kühtreiber von der Medizinischen Universität Wien für die Unterstützung beim Erstellen dieses Beitrages bedanken!
cs, 30.05.2025
Quellenangaben
[1] Goldsmith L. A. (1990). My organ is bigger than your organ. Archives of dermatology, 126(3), 301–302.
[2] Fritsch P, Schwarz T. Dermatologie Venerologie. Berlin, Heidelberg: Springer; 2018
[3] Wolff, K., Goldsmith, L., Katz, S., Gilchrest, B., Paller, AS., & Leffell, D. (2011). Fitzpatrick's Dermatology in General Medicine, 8th Edition. McGraw-Hill.
[4] Pfisterer, K., Shaw, L. E., Symmank, D., & Weninger, W. (2021). The Extracellular Matrix in Skin Inflammation and Infection. Frontiers in cell and developmental biology, 9, 682414. https://doi.org/10.3389/fcell.2021.682414
[5] Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. Elsevier Health Sciences; 2014. 547 p.
[6] Tamari, M., Ver Heul, A. M., & Kim, B. S. (2021). Immunosensation: Neuroimmune Cross Talk in the Skin. Annual review of immunology, 39, 369–393. https://doi.org/10.1146/annurev-immunol-101719-113805
[7] Shibai, A., Takahashi, Y., Ishizawa, Y. et al. Mutation accumulation under UV radiation in Escherichia coli . Sci Rep 7, 14531 (2017). https://doi.org/10.1038/s41598-017-15008-1
[8] Chadwick, K. H., & Leenhouts, H. P. (1976). The correlation between mutation frequency and cell survival following different mutagenic treatments. TAG. Theoretical and applied genetics. Theoretische und angewandte Genetik, 47(1), 5–8. https://doi.org/10.1007/BF00277398
[9]Österreichische Krebshilfe: Krebsneuerkrankungen und Krebssterblichkeit in Österreich, abgerufen am 30.05.2025
[10] Deutsche Krebshilfe: Hautkrebs, abgerufen am 30.05.2025
[11] Nieboer, A., Lindenberg, S., Boomsma, A., & van Bruggen, A. (2005). Dimensions of well-being and their measurement: The SPF-IL scale. Social Indicators Research, 73(3), 313–353. https://doi.org/10.1007/s11205-004-0988-2
[12] Deutsches Bundesamt für Strahlenschutz: UV-Schutz durch Sonnencreme, abgerufen am 30.05.2025
[13] Direder, M., Weiss, T., Copic, D., Vorstandlechner, V., Laggner, M., Pfisterer, K., Mildner, C. S., Klas, K., Bormann, D., Haslik, W., Radtke, C., Farlik, M., Shaw, L., Golabi, B., Tschachler, E., Hoetzenecker, K., Ankersmit, H. J., & Mildner, M. (2022). Schwann cells contribute to keloid formation. Matrix biology : journal of the International Society for Matrix Biology, 108, 55–76. https://doi.org/10.1016/j.matbio.2022.03.001